EXERCICES: cinetique chimique
Exercice 1:
On mélange 50 cm3 d’une solution incolore d’iodure de potassium à 0,5 mol/L et 50 cm3 d’une solution incolore de péroxodisulfate d’ammonium à 0,05 mol/L.
Le mélange de couleur jaune-orangé est divisé en dix systèmes identiques que l’on dose successivement.
Le contenu du troisième bécher subit la trempe (dilution et brusque refroidissement) au bout de 320s, puis on dose le diiode formé par une solution de thiosulfate de sodium à 0.02mol/L.
La coloration bleue due à l’empois d’amidon disparaît quand on a ajouté 3,8 cm3 de solution de thiosulfate.
- Calculer la concentration en diiode à l’instant de date 320s.
- En déduire la composition du mélange réactionnel à cet instant.
DONNEES DU PROBLEME
Exercice 2:
On mélange une solution d’iodure de potassium à une solution de péroxodisulfate de sodium.
A partir de concentrations initiales différentes, on se livre à deux séries d’expériences.
La température est la même dans les deux séries d’expérience.
- Ecrire l’équation bilan de la réaction.
- Sur du papier millimétré, tracer les deux graphes:
 .
. - Déterminer la vitesse de formation du diiode au temps t=0 pour les deux séries d’expériences.
- Comparer les valeurs trouvées et conclure.
Exercice 3
Dans un ballon de 250 mL, on verse 10mL de solution d'acide chlorhydrique de concentration 1 mol/L et 20 mL d'eau. On y ajoute rapidement 3 cm d'un ruban de magnésium bien décapé, tout en déclanchant un chronomètre. On ferme et on recueille le dihydrogène qui se dégage dans une éprouvette graduée, retour - mesurée sur une cuve à eau. On relève toutes les minutes le volume V (mL) du gaz.
- Ecrire la réaction d'oxydoréduction entre le magnésium Mg et les ion oxonuim.
- Tracer le graphe V= f(t).
- A partir de quelle date peut-on considérer que la réaction est terminée ?
- La transformation est-elle lente ou rapide ?
- A partir du graphe déterminer la quantité de matière (mol) de dihydrogène en fin d'expérience sachant que la température est 20°C et la pression 101300 Pa. - Dresser le tableau permettant de suivre l'évolution de la transformation en fonction de l'avancement x.
- Déterminer l'état final du système et comparer avec les résultats expérimentaux. - On recommence la même expérience avec la même longueur de magnésium, mais on verse 10 mL d'acide chlorhydrique de concentration 2 mol/L. On y ajoute 20 mL d'eau. Quelle est l'allure de la courbe ? Justifier.
masse atomique molaire (g/mol) : Mg = 24,3 ; masse linéique du ruban de magnésium : 1 g /m. R= 8,318 S.I.
Exercice 4: Esterification de l’éthanol par l’acide méthanoique (1998)
1. A l’aide de formule générale écrire l’équation bilan de la réaction entre un acide carboxylique et un
alcool.
2. Préciser les caractères de cette réaction.
3. Pour réaliser l’étude cinétique de ce type de réaction on part d’éthanol et d’acide méthanoïque de
même concentration 0,6 mol/L. On en mélange des volumes égaux et l’on fait deux parts égales A et B.
– à A on ajoute 0,5 mol d’acide sulfurique à 0,1 mol/L – à B on ajoute 0,5 mol d’acide sulfurique à 0,2 mol/L A différentes dates t on détermine la concentration de l’ester formé. Les courbes 1 et 2 représentent, en
fonction du temps, les variations de la concentration de l’ester formé respectivement pour A et B.
a. Pour chaque cas envisagé, déterminer la vitesse instantanée de formation de l’ester formé à la date
t = 200 s. On expliquera la méthode utilisée. Les courbes ne sont pas à rendre..
b. Comparer ces valeurs et indiquer le rôle jouer par l’acide sulfurique.
c. Déterminer les concentrations en mol/L de l’acide méthanoïque, de l’alcool et de l’ester à la date
t = 300s pour chaque cas.
d. Les deux essais tendent-ils vers la même limite ? Justifier la réponse
NB : Le volume de l’acide sulfurique ajouté est négligeable par rapport, à celui des échantillons

Exercice 5: Dosage du diode par le thiosulfate de sodium ( 1999)
Les ions peroxydisulfates sont lentement réduits par les ions iodures selon l’équation- bilan :
![]()
![]()
Si on verse à l’avance une quantité de thiosulfate de sodium ![]() dans le milieu réactionnel, il réagit
dans le milieu réactionnel, il réagit
avec le di-iode formé selon l’équation- bilan :
![]()
![]()
cette réaction empêche l’apparition de la couleur brune du diiode et régénère les ions iodures instantanément.
On peut déterminer alors, le temps nécessaire pour qu’il se forme n moles(s) de diiode dans la réaction (I).
On prépare pour cela une solution contenant :
- 10 mL de solution d’iodure de potassium de concentration molaire volumique 1 mol/L
- Assez d’eau pour considérer le volume constant.
- 2 mL de thiosulfate de sodium de même concentration molaire volumique que la solution d’iodure de potassium.
A l’instant de date t = 0, on ajoute 2 mL de peroxydisulfate à 5 mol/L ; à l’instant de date ![]()
apparaît la coloration du diiode, on ajoute alors 2 mL de thiosulfate qui fait disparaître la coloration
brune ; elle réapparaît à la date ![]() . On ajoute alors 2 mL de solution de thiosulfate etc. Ce qui permet de dresser le tableau de mesure ci-dessous :
. On ajoute alors 2 mL de solution de thiosulfate etc. Ce qui permet de dresser le tableau de mesure ci-dessous :


1/ Expliquer comment cette méthode permet d’obtenir n et tracer le graphe représentant les variations
de n en fonction de t.
Echelles : ![]()
![]()
![]()
![]()
2/ Déterminer la vitesse de formation v du diiode au cours de la réaction (I), aux dates t = 200 s et t = 1000s
Comment varie la vitesse ? Quel est le facteur cinétique qui fait varier v ?
3/ Quelle sera la quantité de diiode formé par la réaction au bout d’un temps infini ?
Exercice 6 (2005)
On étudie la cinétique de la réaction de l’eau oxygénée avec les ions iodures I -.
L’équation bilan de la réaction s’écrit :
H![]() O
O![]() + 2I
+ 2I![]() + 2H
+ 2H![]()
![]() 2H
2H![]() O + I
O + I![]()
A la date t = 0 seconde, on mélange une quantité connue d’eau oxygénée avec un excès d’une solution d’iodure de potassium acidifiée. Par une méthode appropriée, on détermine la concentration en eau oxygénée, [H2O2], dans le milieu réactionnel à différentes dates t. Les résultats obtenus sont consignés dans le tableau suivant :
2.1. La réaction étudiée est - elle une réaction d’oxydoréduction ? Justifier la réponse et préciser s’il s’agit d’une réaction d’oxydoréduction, les couples oxydant-réducteur en jeu, l’espèce réduite et l’espèce oxydée. (01 point)
2.2. Tracer le graphe [H2O2] = f(t).
Echelle :
1 cm pour 50 s ;
5 cm pour 10-3 mol/L. (01 point)
2.3. Définir la vitesse instantanée de transformation de l’eau oxygénée. Déterminer cette vitesse aux dates t = 0 s et t = 366 s. (01 point)
2.4. Comment évolue cette vitesse au cours du temps ? Quel est le facteur cinétique ainsi mis en évidence ? (0,5 point)
2.5. Les résultats précédents ont été obtenus à la température ambiante ![]() . Expliquer comment on pourrait mettre en évidence expérimentalement l’influence de la température sur la vitesse de réaction. Ebaucher sur le même système d’axes que le précédent la courbe [H2O2] = g(t) qu’on aurait obtenu à une température
. Expliquer comment on pourrait mettre en évidence expérimentalement l’influence de la température sur la vitesse de réaction. Ebaucher sur le même système d’axes que le précédent la courbe [H2O2] = g(t) qu’on aurait obtenu à une température ![]() >
> ![]() , toutes choses restant égales par ailleurs. (0,5 point)
, toutes choses restant égales par ailleurs. (0,5 point)
Exercice 7 (2004)
NB : Les parties 2-1 et 2-2 sont indépendantes
2.1 : Au laboratoire on veut s’assurer du contenu de 3 flacons repérés par les lettres a, b et c. On sait que chaque flacon contient un seul alcool parmi le butan-1-ol, le méthylpropan-2-ol et le butan-2-ol.
On ajoute au contenu de chaque flacon quelques gouttes d’une solution de dichromate de potassium acidifiée. Les résultats obtenus sont consignés dans le tableau ci-après.
2.1.1 : Ecrire la formule semi développée de chacun des alcools cités ci-dessus. Préciser leur classe. (01,5 point)
2.1.2 : Peut-on déterminer la nature de l’alcool contenu dans le flacon (a) avec les résultats du test réalisé avec la solution de dichromate de potassium ? Justifier. (0,25 point)
2.1.3 : Afin de poursuivre l’identification du contenu des flacons, on chauffe légèrement les solutions vertes obtenues après réaction des alcools contenus dans les flacons (b) et (c). On fait arriver les vapeurs de substances organiques qui se dégagent dans une solution de réactif de Fehling à l’ébullition ; le produit organique venant du flacon (c) donne un précipité rouge brique alors que celui venant du flacon (b) ne provoque pas de réaction.
Attribuer chaque alcool au flacon qui le contient. (0,5 point)
2.14 : Ecrire l’équation bilan de la réaction de l’ion dichromate en milieu acide avec l’alcool contenu dans le flacon (b).(0,5 point)
On donne
- ion dichromate Cr2O72- (coloration orange en solution aqueuse),
- ion chrome III Cr3+ (coloration verte en solution aqueuse).
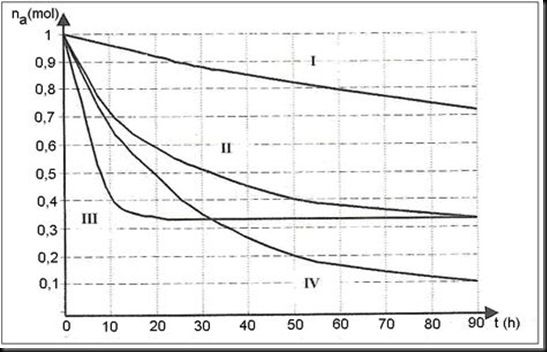
2.2 : On effectue 4 expériences d’estérification d’alcool primaire par un acide organique.
Quantités de réactifs
Pour chaque expérience des mesures ont été effectuées à divers instants t, les mêmes pour toutes les expériences.
Pour chacune d’elles, on note ainsi le nombre de moles d’acide restant au cours du temps.
Ce qui a permis de tracer, à la même échelle et dans le même système d’axes les courbes ci dessous représentatives de l’évolution du nombre de moles d’acide restant en fonction du temps.
2.2.1 : Déterminer graphiquement l’instant t0 auquel le nombre de moles d’acide restant des expériences III et IV est le même. (0,25 point)
2.2.2 : Déterminer la vitesse de disparition de l’acide à l’instant t = 0 pour les expériences II et III. (0,5 point)
2.2.3 : Montrer comment les quatre expériences ci-dessus permettent de mettre en évidence l’influence des différents facteurs dont dépend la vitesse de disparition d’un réactif. (0,5 point)










/http%3A%2F%2Fuploads.siteduzero.com%2Ffiles%2F295001_296000%2F295523.png)
/https%3A%2F%2Fassets.over-blog.com%2Ft%2Fcedistic%2Fcamera.png)